Рездиффра (ресметиром) је одобрила ФДА САД за лечење одраслих са нециротским безалкохолним стеатохепатитисом (НАСХ) са умереним до узнапредовалим ожиљцима на јетри (фиброза), који се користи заједно са исхраном и вежбањем.
До сада, пацијенти са нециротичним неалкохолним стеатохепатитисом (НАСХ) који такође имају значајне ожиљке на јетри нису имали лек који би могао директно да реши њихов проблем. оштећење јетре. ФДА одобрење Рездиффре ће, по први пут, обезбедити а лечење опција за ове пацијенте, поред дијете и вежбања.
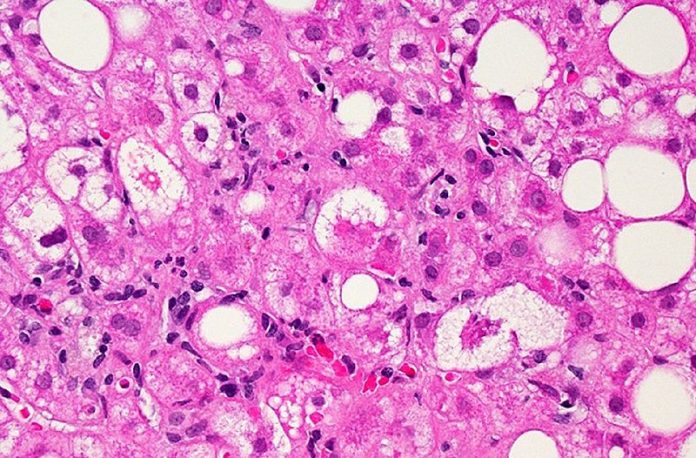
НАСХ је резултат прогресије безалкохолне масти јетра болест где јетра запаљење, током времена, може довести до ожиљака на јетри и дисфункције јетре. НАСХ је често повезан са другим здравственим проблемима као што су висок крвни притисак и дијабетес типа 2. Према најмање једној процени, отприлике 6-8 милиона људи у САД има НАСХ са умереним до узнапредовалим ожиљцима на јетри, а очекује се да ће се тај број повећати.
Рездиффра је делимични активатор рецептора тироидних хормона; активација овог рецептора помоћу Рездиффре у јетри смањује акумулацију масти у јетри.
Безбедност и ефикасност Рездиффре
Безбедност и ефикасност Рездиффре је процењена на основу анализе сурогат крајње тачке у 12. месецу у 54-месечном, рандомизованом, двоструко слепом, плацебом контролисаном испитивању. Сурогатна крајња тачка је мерила обим јетра запаљење и ожиљци. Спонзор је дужан да спроведе студију након одобрења како би потврдио и описао клиничку корист Рездиффре, што ће бити урађено кроз завршетак исте 54-месечне студије, која је још увек у току. Да би се укључили у испитивање, пацијенти су морали да имају а јетра биопсија која показује запаљење због НАСХ са умереним или узнапредовалим јетра ожиљци. У испитивању, 888 субјеката је насумично распоређено да добију једно од следећег: плацебо (294 субјекта); 80 милиграма Рездиффре (298 субјеката); или 100 милиграма Рездиффре (296 субјеката); једном дневно, поред стандардне неге за НАСХ, која укључује саветовање о здравој исхрани и вежбању.
Након 12 месеци, биопсије јетре су показале да је већи проценат испитаника који су лечени леком Рездиффра постигао резолуцију НАСХ-а или побољшање ожиљака на јетри у поређењу са онима који су примали плацебо. Укупно 26% до 27% испитаника који су примили 80 милиграма Рездиффре и 24% до 36% испитаника који су примили 100 милиграма Рездиффре доживело је резолуцију НАСХ-а и није било погоршања ожиљака на јетри, у поређењу са 9% до 13% оних који су добио плацебо и саветовање о исхрани и вежбању. Распон одговора одражава различита читања патолога. Поред тога, укупно 23% испитаника који су примили 80 милиграма Рездиффре и 24% до 28% испитаника који су примили 100 милиграма Рездиффре доживело је побољшање у јетра ожиљци и без погоршања НАСХ-а, у поређењу са 13% до 15% оних који су примали плацебо, у зависности од очитавања сваког патолога. Уочљива је демонстрација ових промена у пропорцији пацијената након само годину дана лечења, као што је болест обично напредује споро, а већини пацијената треба годинама или чак деценијама да покажу прогресију.
Нежељени ефекти Рездиффре
Најчешћи нежељени ефекти Рездиффре укључивали су дијареју и мучнину. Рездиффра долази са одређеним упозорењима и мерама опреза, као што су токсичност јетре изазвана лековима и нежељени ефекти у вези са жучном кесом.
Примену Рездиффре треба избегавати код пацијената са декомпензованом цирозом. Пацијенти треба да престану да користе Рездиффра ако развију знаке или симптоме погоршања јетра функција током лечења Рездиффром.
Интеракције лека Рездиффра
Употреба лека Рездиффра у исто време са одређеним другим лековима, посебно статина за снижавање холестерола, може довести до потенцијално значајних интеракција лекова. Пружаоци здравствених услуга треба да погледају пуне информације о прописивању за додатне информације о овим потенцијално значајним интеракцијама лекова са Рездиффром, препорученим дозама и модификацијама примене.
ФДУ одобрио Рездиффру у оквиру убрзаног пута одобрења, који омогућава раније одобрење лекова који лече озбиљна стања и решавају неиспуњене медицинске потребе, на основу сурогатног или средњег клиничког исхода за који је разумно вероватно да ће предвидети клиничку корист. Захтевана горе поменута 54-месечна студија, која је у току, процениће клиничку корист након 54 месеца лечења Рездиффром.
Рездиффра је за ову индикацију добила ознаке Пробојна терапија, Фаст Трацк и Приорити Ревиев.
ФДУ дао одобрење Рездиффре компанији Мадригал Пхармацеутицалс.
***
Извор:
ФДА 2024. Саопштење за јавност – ФДА одобрава први третман за пацијенте са ожиљцима на јетри због болести масне јетре. Објављено 14. марта 2024. Доступно на https://www.fda.gov/news-events/press-announcements/fda-approves-first-treatment-patients-liver-scarring-due-fatty-liver-disease
***